臨床試験データマネジメントに関する業界調査で、 臨床試験完了の遅延要因が明らかに
~ ライフサイエンス企業の83%がFPFV(First Patient First Visit)に 臨床試験データベースをリリースするため、 主要データマネジメント業務の最終段階では最大1カ月の遅れに ~
臨床試験データマネジメントの専門家を対象にした最大かつ最も詳細な調査によって、企業が臨床試験データベースの構築とリリースにかける時間が、臨床試験の実施・完了にマイナスの影響を及ぼしていることが明らかになりました。(本リリースは、Veeva米国本社が発表した報道資料の抄訳です)
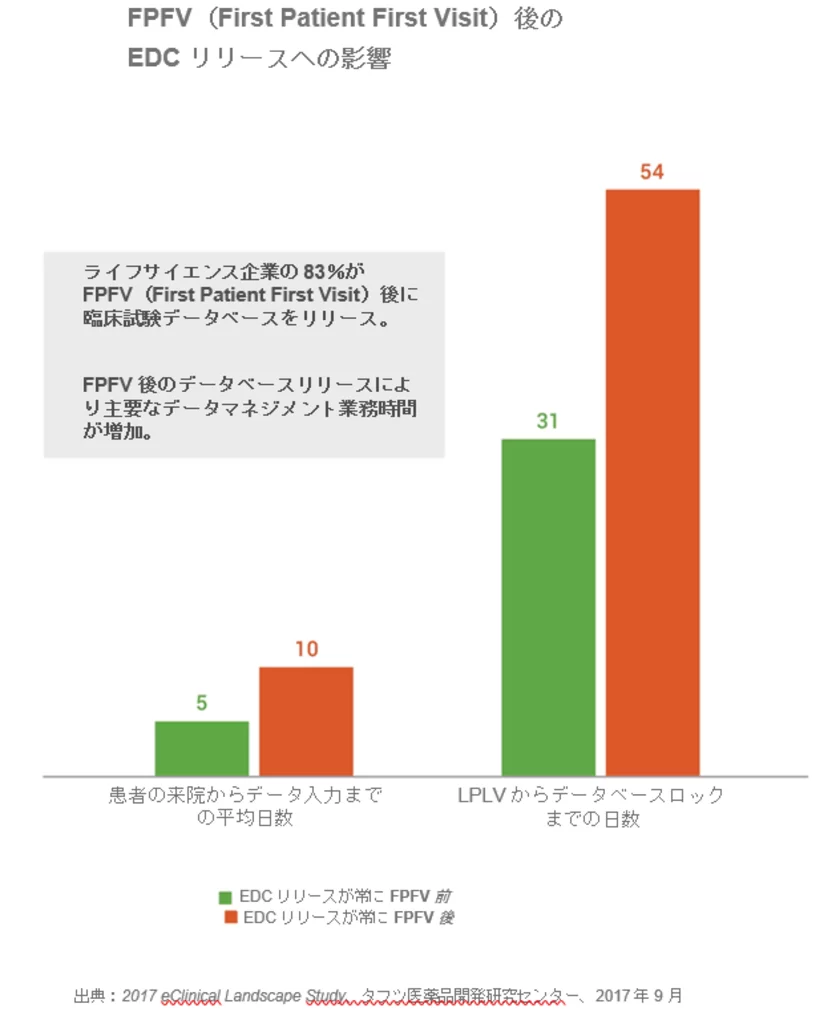
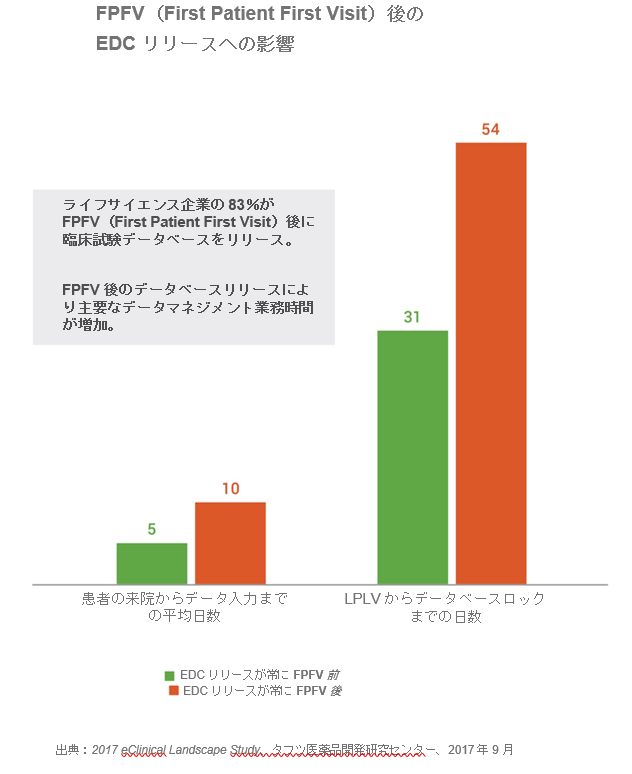
FPFV(First Patient First Visit)後のEDCリリースへの影響
タフツ医薬品開発研究センターの2017 eClinical Landscape Studyによると、企業が臨床試験データベースの構築とリリースにかける日数は平均68日です。臨床試験データベースのリリースの遅れは、患者データの入力や試験終了時にデータベースロックまでの日数など、他のデータマネジメントプロセスの最終段階で約1カ月遅延する要因となっています。FPFV(First Patient First Visit)後にデータベースをリリースする場合は、FPFV前に最終的なデータベースをリリースする場合と比べ、試験全体を通して患者データを入力する期間が2倍近くかかり、データベースロックが約75%遅くなっていました。
タフツ医薬品開発研究センター長であるKen Getz特任准教授は次のように述べています。「調査結果は、臨床試験データベースの構築と管理において、企業がますます多くの課題に直面していることを示しています。また、試験実施医療機関で症例登録を開始した後の臨床試験データベースをリリースすることが、試験終了時や実施医療機関での最終段階のサイクルタイムを長引かせる要因になっていることも分かりました。」
■Electronic Data Capture(EDC)プロバイダー及びシステム利用
EDCは最も広く採用されている臨床業務アプリケーションで、すべての回答者(100%)が使用しています。次に、RTSM(Rndomization and Trial Supply Management)(77%)、eTMF(70%)、安全性(70%)の各システムと続きます。回答者の大多数(58%)が主要なEDCシステムとしてMedidata RaveかOracle Informのいずれかを使用しています。
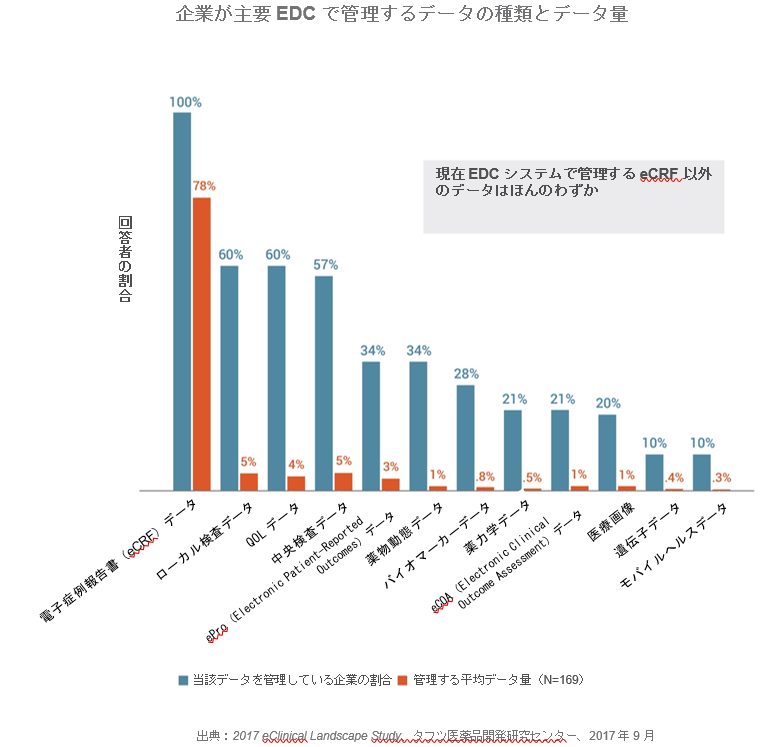
EDCで管理しているデータの種類については、すべてのCROと治験依頼者が電子症例報告書(eCRF)データ(100%)と回答し、ローカル検査データとQOLデータがそれぞれ60%で続きます。但し、データ量でいうと、EDCシステムで管理するデータの中で最もデータ量が多いのはeCRFデータ(管理するデータの平均78%)と回答しています。次に量の多いデータは、中央検査データとローカル検査データでそれぞれ5%です。残りのデータの種類はいずれも4%以下です。この結果は、EDCで全試験データを管理するという業界のビジョンをサポートするプロセスとシステムの必要性を示しています。
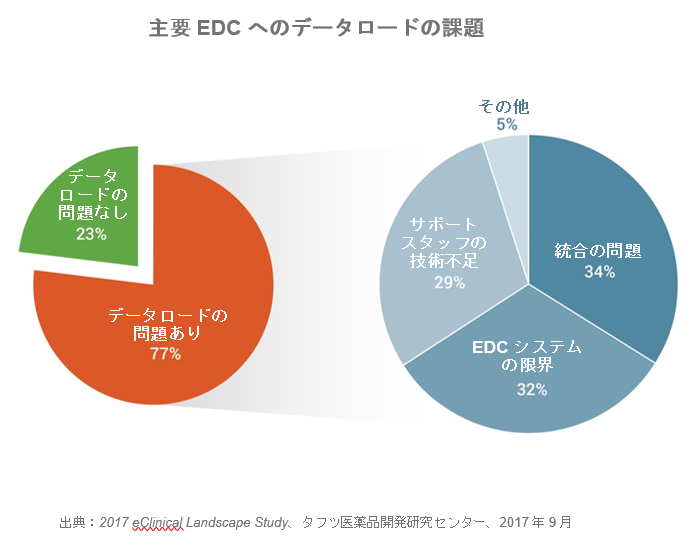
そして、4分の3以上(77%)がEDCアプリケーションへのデータのロードに問題があると回答し、大半(66%)がEDCシステムそのものまたはEDCシステムとの連携の問題が、試験データをロードできない主な理由であるとしています。
■臨床試験サイクルタイムに及ぼすデータベース構築遅延の影響
今回の調査結果から、臨床試験データベース構築遅延の一般的な要因がいくつか分かりました。プロトコールの変更と答えた回答者の割合が最も多く45%で、データマネジメント担当者が臨床試験開始時に臨床試験データベースを完成させながら変更に対処しているという問題を浮き彫りにしています。このことは、より柔軟な設計と迅速な開発をサポートする標準とシステムで、データベース設計のプロセスを最適化する必要性を強調するものです。
データベースのリリースの遅れもまた、実施医療機関が臨床試験全体を通してEDCに患者データを入力する時間、そして試験終了時の最終的なデータベースロックに大きな影響を及ぼします。FPFV前にデータベースをリリースする企業は、EDCへのデータ入力が患者の来院から平均5日ですが、 FPFV後にリリースする企業のデータ入力は、その倍の10日かかります。
データベース構築遅延は、データベースロックまでの日数にさらに大きく影響します。常にFPFV前にデータベースをリリースする企業は、データベースロックまで平均31日ですが、常にFPFV後にデータベースをリリースする企業は、データベースロックが3週間以上(54日)遅くなっています。
治験依頼者はCROよりも約4割長く、データベース構築に73日(CROは53日)、データベースロックに39日(CROは28日)かかっています。また、データサイクルタイムは、2大EDCシステムを使用している企業が123日で、他のシステムを利用している企業の99日より約2割長くなっています。この内訳は、データベース構築が75日対60日、患者データ入力が9日対7日、データベースロックが39日対32日です。
Veeva Vault EDC担当ヴァイスプレジデントのRichard Youngは次のように述べています。「データベース構築プロセスは10年前からほとんど変わっていません。CROや治験依頼者が管理する臨床試験データの種類が増えたことにより、プロセスが複雑化しただけです。企業は入力するデータの量を減らすことにより技術的な限界を補っています。私たちは治験依頼者やCROが制限されずに臨床試験を行えるよう、EDCシステムの改善に重点を置く必要があります。」
Veeva Systems【NYSE:VEEV】(本社:カリフォルニア州プレザントン、日本法人本社:東京都渋谷区、日本法人代表取締役:岡村 崇)が出資するタフツ医薬品開発研究センター の「2017 eClinical Landscape Study:Assessing Data Management Practices, Performance, and Challenges」により、平均17年の臨床試験データマネジメント経験を持つ治験依頼者やCROを含む250社以上の臨床試験データマネジメントの専門家の知見や意見を徹底的に調査し、ライフサイエンス業界におけるデータマネジメントの実態を見直しました。調査報告書は https://www.veeva.com/jp/edc-survey よりダウンロードできます。
【タフツ医薬品開発研究センターについて】
タフツ大学のタフツ医薬品開発研究センターは、医薬品の開発、見直し、利用の質と効率の改善に役立つ戦略的情報を医薬品開発企業、規制当局、政策立案者に提供しています。ボストンを拠点とするタフツ医薬品開発研究センターは、医薬品に関する問題の幅広く詳細な分析、シンポジウム、ワークショップ、パブリックフォーラムの主催、タフツ医薬品開発研究センター影響報告書の発表、隔月ニュースレターの発行など、重要な医薬品開発の問題の分析と知見を提供します。詳細については http://csdd.tufts.edu をご覧ください。
【Veeva Systems社について】
Veeva Systems社はグローバルなライフサイエンス企業向けにクラウドベースのソフトウェアを提供するリーディングカンパニーです。世界最大規模の製薬会社からバイオテクノロジー分野の新興企業まで550社を超える顧客を擁し、技術革新への取り組みや卓越した製品力によって、お客様の成功をサポートしています。Veevaは、サンフランシスコのベイエリアに本社を置き、ヨーロッパ、アジア、ラテンアメリカに拠点を展開しています。
詳しくは、 https://veeva.com/jp/ をご覧ください。
■調査のハイライト
2017 eClinical Landscape Study:データマネジメント業務、実績、課題の評価
2017 eClinical Landscape Studyは、ライフサイエンス業界における臨床試験データマネジメントの状況調査です。調査の目的は、現在の臨床試験データマネジメント業務の把握とElectronic Data Capture(EDC)システムの実績および課題の評価です。
これまでで最大かつ最も詳細な臨床試験データマネジメント調査の一つである本調査は、平均17年にわたる臨床試験データマネジメント経験を持つ治験依頼者やCROを含む250名の臨床試験データマネジメントの専門家の知見や意見を集めました。
<臨床業務システム及びEDCデータ状況>
● EDCアプリケーションは最も広く普及している臨床業務アプリケーションで、すべての回答者(100%)が使用しています。次に、RTSM(Rndomization and Trial Supply Management)(77%)、安全性/医薬品安全性監視(70%)、eTMF(70%)、臨床試験管理システム(CTMS)(61%)と続きます。
● 回答者の大多数(58%)が主要なEDCアプリケーションとしてMedidata RaveかOracle Informのいずれかを使用しています。他に6%以上使用されているアプリケーションはありませんでした。
● すべての回答者がEDCシステムを使用していますが、約3分の1(32%)は紙の症例報告書(CRF)も使用しており、こうした企業が臨床試験データマネジメントを依然として手作業で行っていることを示唆しています。
● 企業によると、eCRFデータ(100%)、ローカル検査データ(60%)、QOLデータ(60%)、中央検査データ(57%)、ePROデータ(34%)など幅広い種類のデータを主要EDCシステムで管理しています。遺伝子データまたはモバイルヘルスデータをEDCで管理している企業はわずか10%に過ぎません。
● 企業はEDCで様々な種類のデータを管理していますが、最も割合が高いと回答したデータはeCRFデータです(推定される割合は管理するデータの78%)。その他の種類のデータは、ローカル検査データ(5%)、中央検査データ(5%)、QOLデータ(4%)、ePROデータ(3%)でEDCのデータ総量の5%以下と推定されます。EDCシステムで遺伝子データとモバイルヘルスデータが占める割合は最も小さく、それぞれ0.4%と0.3%です。
<臨床試験データマネジメントサイクルタイム>
● 平均すると、試験データベースの設計とリリースに68日、試験全体を通してEDCシステムへのデータ入力は患者の来院から8日、LPV(Last Patient Visit)からデータベースロックまでに36日かかっています。
● 治験依頼者と同様に、最も広く普及している2大EDCアプリケーション(Medidata RaveとOracle Inform)を使用している企業の方が、試験データベースの設計とリリース、LPLV(Last Patient Last Visit)後のデータベースロックに時間がかかっています。
〇 データベースの構築とリリースの平均日数
・ 治験依頼者の73日に対しCROは53日
・ 最も広く使用されている2大EDCシステム利用者75日に対し、他のEDCシステム利用者は60日
〇 試験データベースロックまでの平均日数
・ 治験依頼者の39日に対しCROは28日
・ 最も広く普及している2大EDCシステム利用者の39日に対し、他のEDCシステム利用者は32日
<臨床試験データベース構築時間と臨床試験サイクルタイムへの影響>
● 臨床試験データベースの構築とリリースにかかる初期時間は、試験全体を通じたEDCへの患者データ入力時間、LPLV(Last Patient Last Visit)後の最終的なデータベースロック時間など、最終段階のプロセスに大きな影響を及ぼす可能性があります。
〇 FPFV前にデータベースをリリースする企業は、患者の来院からEDCにデータを入力するまでが平均5日、データベースロック期間が31日です。
〇 FPFV後にデータベースをリリースする企業は、患者の来院からEDCにデータを入力するまでが平均10日、データベースロック期間が54日です。
● 治験依頼者の約3分の1(32%)が「頻繁に」または「常に」FPFV後にEDCをリリースしていますが、CROは20%です。
● 最も普及している2大EDCアプリケーションを使用している企業の3分の1(36%)が「頻繁に」または「常に」FPFV後にEDCをリリースしているのに対し、それ以外のEDCアプリケーションを使用している企業は、22%がFPFV後にEDCをリリースしています。
<データベース構築における遅延要因上位とデータロードの課題>
● データベース構築遅延の最も一般的な要因はプロトコールの変更(45%)で、次にユーザー受け入れテスト(17%)、データベース設計の機能性(15%)と続きます。
● プロトコールの変更によるデータベース構築の遅れは治験依頼者(44%)よりもCRO(52%)が高くなっていますが、設計の機能性によるデータベース構築の遅れは治験依頼者(18%)よりもCRO(7%)が低くなっています。
● データベース設計の機能性によるデータベース構築の遅れは、LPLV後のデータベースロックに大幅な時間がかかる要因になります(平均50日対36日)。
● 回答者の4分の3(77%)が主要EDCシステムにデータをロードできない問題を抱えています。大半(66%)がEDCシステムそのものや連携の問題をデータがロードできない最重要課題として挙げています。
FPFV(First Patient First Visit)後のEDCリリースへの影響
主要EDCへのデータロードの課題
企業が主要EDCで管理するデータの種類とデータ量
(R) 2017 Veeva Systems Inc. All rights reserved. Veeva and the Veeva logo are trademarks of Veeva Systems Inc.
Veeva Systems Inc. owns other registered and unregistered trademarks.
- カテゴリ:
- 企業動向
- タグ:
- 医療 その他IT・インターネット ビジネス全般
記事掲載数No.1!「@Press(アットプレス)」は2001年に開設されたプレスリリース配信サービスです。専任スタッフのサポート&充実したSNS拡散機能により、効果的な情報発信をサポートします。(運営:ソーシャルワイヤー株式会社)















