瓢箪から駒!生分解性プラスチックの微生物合成の過程で 「膜小胞の分泌生産」を世界に先駆けて発見
~培養中に発生した「泡」を起点とした研究ストーリー~
明治大学 農学研究科の佐藤道夫特任講師は、東京農業大学 生命科学部の高相昊研究員、田口精一教授 (兼任:神戸大学大学院科学技術イノベーション研究科・客員教授)、筑波大学生命環境系の野村暢彦教授、豊福雅典准教授らとの共同研究により、生分解性プラスチック*1素材であるポリヒドロキシ酪酸(polyhydroxybutyrate: PHB)*2を生産する大腸菌において、球状ナノ構造体の膜小胞(メンブレンベシクル: membrane vesicle: MV)*3 が形成・放出される現象を世界に先駆けて発見しました。それは、まさに、瓢箪(PHB)から駒(MV)の出来事でした。
研究成果のポイント
●生分解性プラスチックを生産する組換え大腸菌の細胞表面に隆起物を見出し、菌体外に膜小胞 (メンブレンベシクル、membrane vesicle: MV) が放出されていることを発見。
●MVの分泌生産量は、添加するグルコースの 「さじ加減」 によって精密に調節可能であり、工学的応用にアドバンテージ。
概要
本現象を発見するに至ったきっかけは、これまで多くの研究者が見逃してきたPHB生産培養時に発生する 「泡」 に着目したことでした。当初は、泡の形成を促進するような何らかの物質が分泌していると仮説を立て、それを突き止めようと研究に着手しました。我々は電子顕微鏡の専門家とともにPHB生産時の大腸菌そのものを観察することにしました。意外にも、その細胞表面には細胞膜が湾曲してできたイボ状の隆起物が無数に観察され、その正体がMVであると各種の化学分析によって判明しました。
特筆すべきは、グルコースの添加量に依存して、極めて高い相関係数(R2=0.99625)で、PHBの合成量に比例してMVが分泌したことでした。このことは、グルコースのさじ加減によってMVの生産量を自由自在に調節可能であるということを意味しています。また、その相関関係は、同時に大腸菌細胞体積の増大に連動しており、PHBが細胞内に合成蓄積することで生じる内圧に起因する膜へのストレスによってMVの生成・分泌が誘発されるメカニズム「Polymer-Intracellular Accumulation-induced Membrane Vesicle Production: PIA-MVP」を提案しました。
今回の発見は、新たな原理に基づいたMV微生物生産の基盤技術として役立つものと期待されます。さらに、本現象を応用することで、ワクチン開発や有用物質の輸送体としての利用が期待でき、医学・産業分野に貢献することが期待されます。
本研究成果は、日本時間2022年3月1日19時付(英国時間2022年3月1日10時付)でNature姉妹誌 「Scientific Reports」に掲載されました。
科学技術振興機構(JST)のA-STEP機能検証フェーズ実証研究(JPMJTM19YC to S. Taguchi)およびJSPS科研費(19K22069 to S. Taguchi)、JST-ERATO(JPMJER1502 to N. Nomura)およびサントリーSunRiSE 生命科学研究者支援プログラム(SunRiSE to M. Toyofuku)の一部助成を受けたものです。
研究背景
自然界において多くの細菌は、自身の細胞膜で覆われた球状構造体である膜小胞(membrane vesicle: MV)を環境中に放出します。MVは、細菌間の遺伝子の水平伝搬、細胞間相互作用、抗生物質耐性などに関与する媒体として機能しており、いわば、細菌間でのコミュケーションツールとして使われています。近年では、MVをナノカプセルとして見立てて、有用化合物の運搬や、有用酵素を内包させたナノ反応工場として利用が検討されており、MVそのものがワクチンとして利用されるなど、応用面でも高い潜在能力を秘めています。その一方、これら多彩なMVの機能に対して、一体どのようにしてMVが形成されるかについてはほとんど理解が進んでいません。そのために、MVを自然発生的に作るのではなく、人為的かつ制御可能な方法で自由自在に作れるような生産技術の開発は進んでおりませんでした。
研究成果
これまでに我々は、バイオマス由来のグルコース原料から高付加価値化成品の創成を目指して、遺伝子組換え大腸菌を利用した生分解性プラスチックの生産技術開発に取り組んでいます。最初からMVを研究対象としたわけではなかったので、全く意図しない偶発的な発見でした。ことの発端は、PHBを培養生産している際に特徴的に発生する 「泡」 に着目したことがきっかけでした(図1)。 その原因を突き止めようと、電子顕微鏡の専門家とともに、走査型電子顕微鏡を用いてPHB生産時の大腸菌の形態を観察することにしました。意外にも、その細胞表面には細胞膜が湾曲してできたイボ状の隆起物が無数に観察されました(図2)。 MV生成の特定は、走査型電子顕微鏡による膜表層の観察、密度勾配超遠心により回収した菌体外成分の各種生化学的データや膜構造の透過型電子顕微鏡による解析により行なった(図2)。
非常に興味深い点は、このMVが発生する仕組みでした。PHB合成とMV発生との間が如何に関連するかを調べるために、原料として加えたグルコースの量によって細胞内PHBの合成量を調節したところ、MVの発生量がPHBの合成量に依存して分泌することがわかりました。特に、MVの発生量とPHBの合成量との相関関係係数は、R2=0.99625(値が1に近づくほど相関性が高い)を示しており、極めて密接な関係性が見出されました。このことは、培地中に添加したグルコースの 「さじ加減」 によってMVの生産量を自由自在に調節可能であるということを意味しています。さらに、この正の相関関係は、大腸菌細胞体積の増大に連動しており、PHBが細胞内に合成蓄積することで生じる内圧に起因する膜へのストレスによってMVの生成・分泌が誘発されるメカニズム「Polymer-Intracellular Accumulation-induced Membrane Vesicle Production: PIA-MVP」を提案しました(図3)。
本研究の意義と今後の展開
大腸菌がMVを生成することは過去にも報告がありますが、細胞膜や細胞壁の合成に関わる遺伝子変異によるものが多く、今回のようにポリマー合成による内圧が発生源になるメカニズムの発見は全く新規なことです。このことは、これまで独立に発展してきたMVの研究分野と生分解性プラスチック素材PHBの研究分野の両方の「架け橋」となるインパクトを与えることになると考えています。
MVは現在、ワクチン媒体をはじめとするドラッグデリバリーシステム(DDS)基材開発への展開として医療的にも注目されていることから工学的応用面で有用です。特に、ロットの均一性を求められる用途開発において、本技術のグルコース添加量で精密にMVの分泌生産量を調節できる点は、Quality Controlに優れたMV生産体系を提供し社会実装へ貢献することが期待されます。
今後は、MV生産のさらなる高精度化・高生産化を目指して、PIA-MVPの分子メカニズム解明を詳細に進めていく予定です。また、操作性に優れている大腸菌をプラットフォームとする本システムの特質を活かし、既存のMV発生誘導方法(遺伝子組換えによる細胞膜変異、化学物質添加による細胞膜変質)など他のアプローチとの組み合わせにより、さらなる本システムの用途別の最適化が可能になると期待できます。
論文情報
【題目】
Controllable secretion of multilayer vesicles driven by microbial polymer accumulation
(バイオポリマー細胞内合成による膜小胞の分泌誘導とその制御)
【著者名】
Sangho Koh, Michio Sato, Kota Yamashina, Yuki Usukura, Masanori Toyofuku, Nobuhiko Nomura & Seiichi Taguchi
【掲載誌】
Scientific Reports
URL:www.nature.com/articles/s41598-022-07218-z
DOI:10.1038/s41598-022-07218-z
用語解説
*1生分解性プラスチック
植物や微生物などバイオマス(再生可能な未利用生物資源)を利用してつくる生分解性機能を有したバイオプラスチック。石油などの化石資源を使わないため、二酸化炭素を増やさないカーボンニュートラルなプラスチックとして、近年、マイクロプラスチック問題解決の切り札として期待されている。
*2ポリヒドロキシ酪酸(PHB)
PHBは、生分解性プラスチック素材であり、多くの微生物がエネルギー貯蔵物質として細胞内で合成蓄積される。また、グルコース原料から大腸菌で組換え生産可能であり、その効率を上げ材料化する研究が活発に進められている。近年では、進化工学的アプローチによって多元ポリ乳酸の開発が進み、実用化に向けた動きがある。
*3 膜小胞(メンブレンベシクル、membrane vesicle: MV)
多くの細菌が放出する、直径おおよそ20-400 nmで、リン脂質の脂質二重膜と外膜蛋白質によって覆われた球状ナノカプセル。近年では、国外においてMVを利用した抗ウイルス・ワクチン開発が進んでおり、カプセル内に薬剤を封入したドラッグデリバリーシステムとして利用検討が盛んに行われており、医療・産業面で注目されている。
参考図

図1 PHBの生産培養中に発生する 「泡」
(左) PHBを生産する大腸菌の培養液、(右)PHBを生産しない通常の大腸菌の培養液の写真の比較。全く同一の培養条件での実験であるが、明らかに泡の発生の仕方が違い、この泡がPHB生産時に特徴的に発生することがわかる。この泡が何か?という知的探求が本現象発見のきっかけに繋がった。

図2 生分解性プラスチック生産大腸菌からMVが隆起する瞬間を捉えた電子顕微鏡像
(左) 生分解性プラスチック生産大腸菌の細胞表面からまさにMVが隆起し始めている様子を捉えた顕微鏡写真、(右)細胞表面から放出された後のMVの顕微鏡写真。MVの平均粒子径:93.2 ± 3.1 nm。外膜の脂質層からなる単層MVと内膜と外膜の2重膜からなる多層MVが発生する。
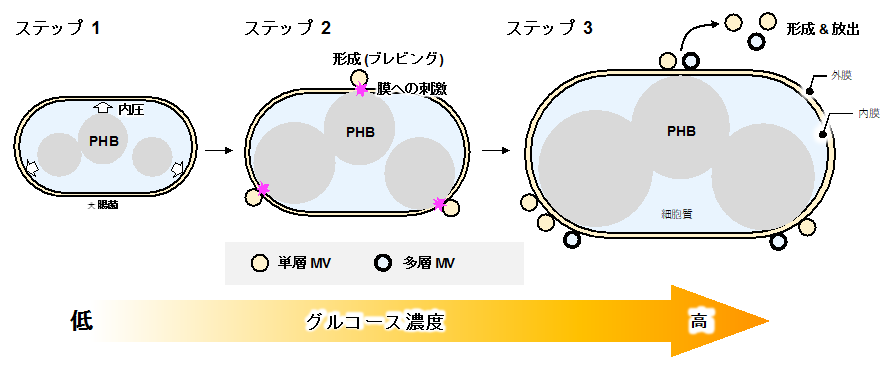
図3 PHB合成駆動型MV発生システム (PIA-MVP) の仕組み
(ステップ1)PHBの合成・蓄積によって膜に内圧がかかる。(ステップ2)PHBの蓄積量増大によって膜を刺激し、膜の湾曲によってMVの前駆体が形成される。(ステップ3)やがて、膜が球状を保つようにして閉じることでMVが放出される。



















