炎症性腸疾患の新たな病態機序を解明
~線溶系因子プラスミンを標的とした新しい分子療法の可能性~
順天堂大学大学院医学研究科・ゲノム・再生医療センターの服部浩一先任准教授、同大下部消化管外科の宗像慎也らは、疾患モデル動物(マウス)において、炎症性腸疾患に対する血液線維素溶解系(線溶系)*1因子プラスミン*2を標的とした新たな治療に成功しました。本研究では、炎症性腸疾患の病態において重要な役割を担う線溶系の役割を明らかにし、線溶系因子プラスミンに対する阻害剤が、動物実験における炎症性腸疾患の病勢を制御し、予後を有意に改善することを提示しました。本研究成果は、「Gastroenterology」3月1日号に掲載されました。
-
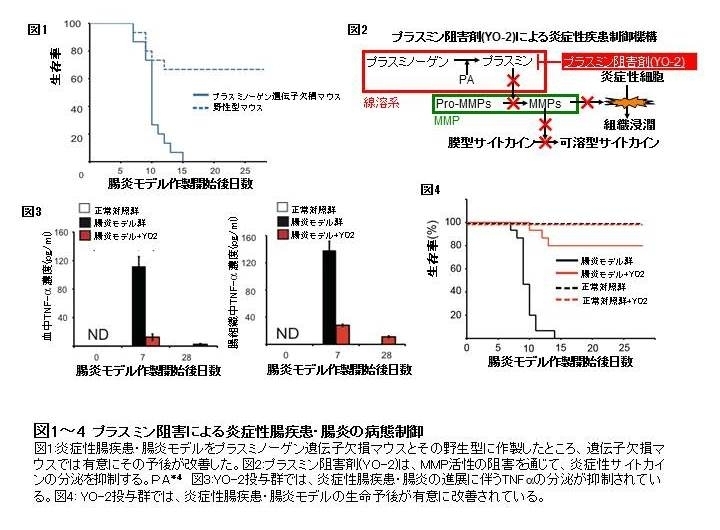
図1、2、3、4
【本研究成果のポイント】
・血液線維素溶解系(線溶系)を起点とする炎症性腸疾患の新たな病態機序を解明
・線溶系因子を分子標的とした化合物が、炎症性腸疾患動物モデルの予後を改善
・炎症性疾患に対する抗サイトカイン療法の代替療法としての可能性
【背景】
潰瘍性大腸炎やクローン病に代表される炎症性腸疾患は、本邦でも年々患者数が増加し、既に15万人を突破しています。炎症性腸疾患の病態では、TNFαをはじめとする炎症性サイトカインとこれらを供給する免疫系、炎症性細胞の役割が重要と考えられています。現在普及している治療法には、5−ASAやステロイド製剤をはじめとする免疫抑制剤、抗TNFα抗体、そして白血球除去療法がありますが、これら内科的治療に抵抗性で、外科手術の適応となる難治症例も少なくありません。炎症性腸疾患の病態を左右する炎症性サイトカインの多くは、細胞表面に膜型の形で産生され、マトリックスメタロプロティナーゼ(MMP)*3という蛋白分解酵素により、その一部が切断され、可溶型となって分泌されます。また、MMPは生体内の炎症性細胞、あるいはがん細胞の動員を促進することで知られており、がん治療薬としてMMP阻害剤の開発が、世界で精力的に進められました。しかしながら、MMP阻害剤は、欧米での治験で判明した深刻な副作用の問題もあって、臨床普及の目処が立っていません。近年の研究では、MMPの活性が、線溶系因子プラスミンによって制御されていることが判明しました。本研究は、プラスミンの活性を阻害する低分子化合物によって、MMPの活性を阻害し、そして炎症性サイトカインの分泌と、これらの供給源となる炎症性細胞の病変組織中への動員・浸潤とを抑制し、包括的に炎症を制御するという、炎症性腸疾患に対する、従来になかった新しい治療法への画期的なアプローチです。
【内容】
私たち研究グループは、炎症性腸疾患における、MMP、そしてプラスミンの役割・機能を解明するため、まず炎症性腸疾患の疾患モデルをMMP-9そしてプラスミンの前駆酵素であるプラスミノーゲン遺伝子欠損マウスとこれらの野性型について作製しました。その結果、これらの遺伝子欠損マウスでは、野生型と比較して重症度、組織傷害が有意に軽減し、生存率が向上することが判明しました(図1)。また野生型群では、重症度に応じて、血中、そして組織中のMMP-9そしてプラスミンのレベルが、有意に上昇すること、これに伴って、炎症性サイトカインであるTNF-αの血中濃度も増加することがわかりました。
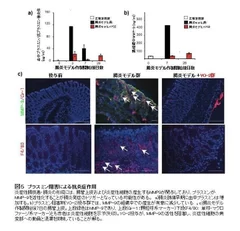
そこで、研究グループは、プラスミンの活性阻害により、MMPの活性を抑制する低分子化合物YO-2(図2)に注目しました。プラスミン阻害剤として神戸学院大学との共同で開発中のYO-2を、炎症性腸疾患・腸炎モデルに投与したところ、投与群では、生体中のMMP-9活性、TNF-α濃度(図3)、重症度とも減少し、生存率が有意に改善されました(図4)。また、投与群では、炎症性細胞の病変組織中への浸潤が抑制されており(図5)、化合物の抗炎症活性が、示唆されました。
【今後の展開】
本研究で、研究グループは、線溶系を起点とした炎症性腸疾患の新たな病態制御機構を明らかにしました。さらに、線溶系因子プラスミンを標的とした分子療法の可能性を示唆しました。本研究で使用した低分子化合物は、炎症製サイトカインの関与する他の炎症性疾患への応用も可能です。また安価でもあることから、炎症性疾患に対する抗サイトカイン療法の代替療法の新規薬剤としての開発が期待できます。
今後は、炎症性腸疾患の前臨床試験に向けた、本薬剤の毒性、安全性、またその薬物動態等にさらなる検討と考察を加え、トランスレーショナルリサーチとしての展開と、他疾患動物モデルでの有効性の精査による、薬剤の適応拡大の模索を考えています。
【用語解説】
*1:血液線維素溶解系
生体血液中において、血液凝固系の亢進による血栓形成を抑制する役割を担う機構。プラスミノーゲン(Plg)はその中心的役割を担う生体因子の一つであり、tPA あるいはウロキナーゼ型PAの作用によりプラスミン(Plasmin)へと活性化され、血栓形成の核となるフィブリンを分解する他、近年マトリックスメタロプロテイナーゼ(MMP)の活性化を制御していることも明らかとなった。
*2:プラスミン
酵素前駆体であるプラスミノーゲンから、組織型プラスミノーゲンアクティベータ(tPA)あるいはウロキナーゼ型プラスミノーゲンアクティベータ(uPA)によって活性化されて生成する線溶系因子。血栓除去に寄与する主要な因子であることが、知られている。
*3:マトリックスメタロプロティナーゼ(MMP)
共通のアミノ酸配列を有し、細胞外マトリックスを基質とするMMP群に属する金属要求性蛋白分解酵素。その多くは潜在型酵素プロ酵素として産生されプラスミンやMMP相互間で活性型MMPへと変換される。生体組織中に骨髄由来細胞(好中球、単球、マクロファージ、マスト細胞、血小板等)が侵入、移動していく際には不可欠と考えられている。
*4:PA
プラスミンの前駆体であるプラスミノーゲンを活性化し、プラスミンへの変換を促進し、血液線維素溶解系を亢進・活性化する生体因子。セリンプロテアーゼに属し、フィブリンを分解する作用を有し、構造の異なる組織型のtPAとウロキナーゼ型のuPAとが存在する。またtPAそしてuPAとも、血栓溶解剤として臨床応用が進んでいる。
【原著論文】
雑誌名: Gastroenterology(http://www.gastrojournal.org/)
タイトル: Inhibition of Plasmin Protects Against Colitis in Mice by Suppressing the Matrix Metalloproteinase 9-mediated Cytokine Release From Myeloid Cells
doi:10.1053/j.gastro.2014.12.001
なお、本研究は、文部科学省、厚生労働省科学研究費等の研究助成のもと、神戸学院大学薬学部(津田裕子教授)、東京大学医科学研究所幹細胞治療研究センターと共同で行ったものです。
プレスリリース添付資料
取材依頼・商品に対するお問い合わせに関しては
プレスリリース内にございます企業・団体に直接ご連絡ください。
記事掲載数No.1!「@Press(アットプレス)」は2001年に開設されたプレスリリース配信サービスです。専任スタッフのサポート&充実したSNS拡散機能により、効果的な情報発信をサポートします。(運営:ソーシャルワイヤー株式会社)